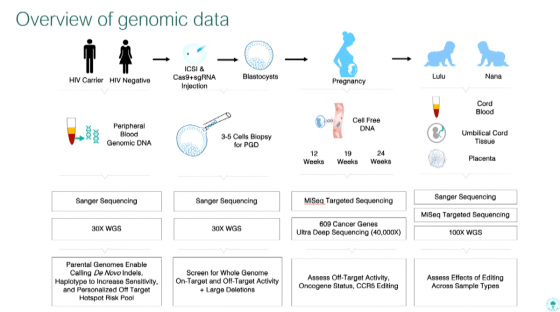
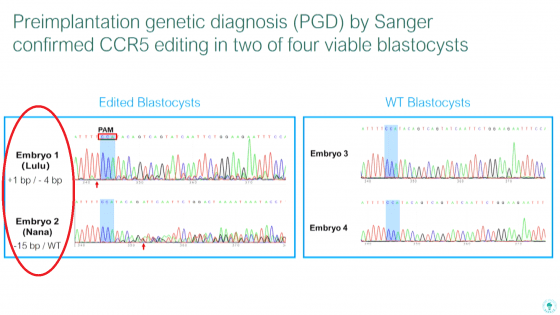
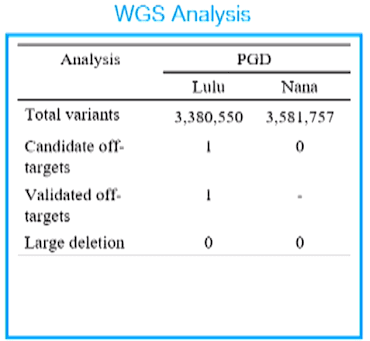
基因編輯技術 CRISPR 的原理
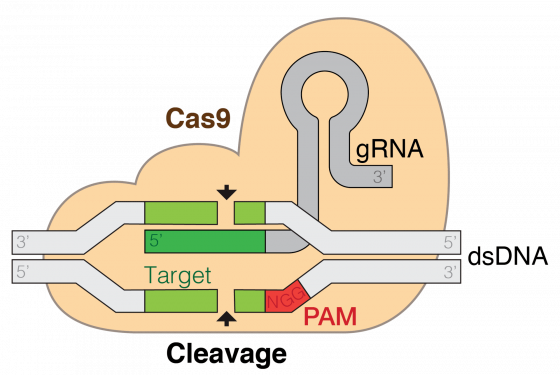
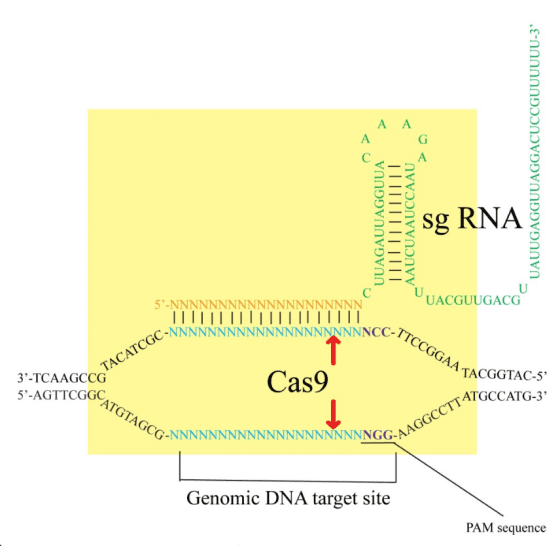
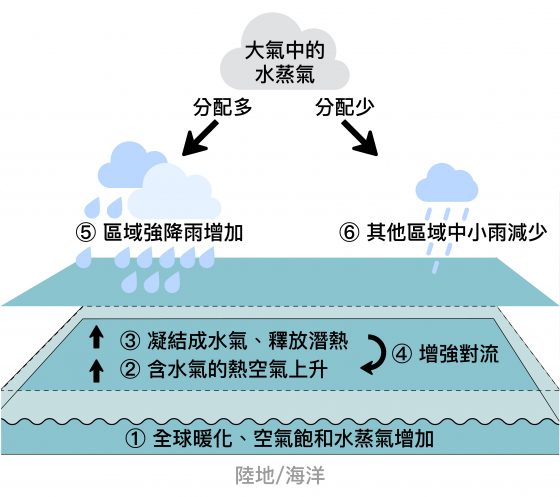
CRISPR(clustered regularly interspaced short palindromic repeat)是一種細菌對抗外來質體(plasmid)或噬菌體(phage)的後天免疫系統(adaptive immunity),細菌會對曾侵入的 DNA 產生記憶,當序列相同的 DNA 再次進入細菌時,會產生免疫反應以分解此外來的 DNA。外來的DNA 首次進入細菌後並未完全被分解,經加工後可嵌入細菌基因體中,稱為 CRISPR 陣列(array),此特殊區段能夠轉錄合成 mRNA(messenger RNA),而菌體中具切割 DNA 活性的蛋白質則會利用 mRNA 片段去辨認互補性的 DNA 片段,並切除符合序列的標的物(圖 1,Barrangou 2010,Church 2013)。
![]()
圖 1 :CRISPR 的作用模式:小型導引 RNA(small-guiding RNA, sgRNA)辨認特定的 DNA 序列後,結合的 CRISPR associated protein 9(Cas9)蛋白會裁切在 DNA 正反兩股的 Protospacer adjacent motif(PAM)NGG 上游各 3 個核苷酸的位置,形成鈍端的雙股斷。 圖/本研究整理。
基因編譯技術目前的優點及困難
CRISPR 廣泛受到基因編譯相關研究人員的採用,主因是具有下列優點:
(1) 無物種限制:動物、植物及微生物均適用此技術進行基因編譯;
(2) 簡單:基因標靶點(target site)搜尋容易,且 DNA 正反兩股皆可設計,質體構築失敗率低,Cas9 蛋白辨識效率高;
(3) 準確:利用 RNA 與 DNA 互補性鹼基配對的原理(complementary base pairing),sgRNA 可以正確的辨認標的 DNA 序列;
(4) 迅速:使用 CRISPR 技術僅需合成特定序列的 DNA 或 RNA,較製造重組蛋白更為穩定且有效率;
(5) 便宜:製作材料僅有引子(primer)、質體及簡單的酵素,所需成本較傳統方法為低。
CRISPR 雖具有很多優點,但仍有下列困難:
(1) 脫靶(off target)效應:未必能完全正確的裁切在標的位置,比率高低很難估計,成品的篩選(screening)及驗證(verification)程序是必要的;
(2) 傳遞工具(delivery tool)的選擇:通常採用病毒、電衝擊(electroporation)、脂質(lipoid)或奈米粒子(nanoparticle)作為傳遞方法,而傳遞成功率攸關作用效能,工具的選擇及效能驗證非常重要。
從基礎研究到生產工具的應用
CRISPR 應用範圍相當廣泛,目前此技術已付諸實際應用或有潛力運用的項目如下:
(一)基礎研究的工具
CRISPR 作為執行動物、植物、微生物基因編譯或基因體分析的技術,過去數年已有很多相關文獻發表(Church 2013,Zhang 2014),是目前最成功且最廣泛的應用,有一些生技公司使用此技術製作轉殖動物、植物及微生物,或者執行人類基因體的分析(Contreras and Sherkow 2017)。
(二)輔助工具的發展
使用 CRISPR 進行研究時所須使用的試劑和周邊設備包括成套工具組(如Surveyor mutation detection kit)、鑑別酵素(如mismatch-specific DNA endonuclease)、次世代定序分析(如next generation sequencing)等,近年開發和銷售這些輔助工具的廠商已如雨後春筍般成立(Contreras and Sherkow 2017)。
(三)生產農工業產品或作為醫療的方法
開發農工業產品、藥品、治療及診斷方法是 CRISPR 最重要的應用,相關產品的預期利益亦最為豐厚,特別是人體治療,目前已有多種農工業產品進入商業化生產,醫療用品則大多仍在研究或臨床試驗階段,真正實際運用到人體者很少(Contreras and Sherkow 2017)。
CRISPR 技術轉移、智慧財產權及應用的現況
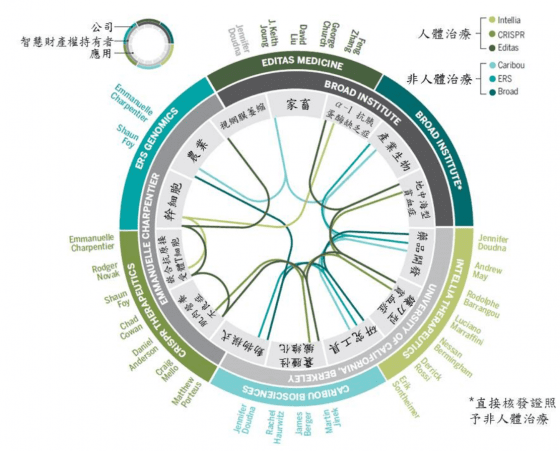
CRISPR 在先進國家研究成果豐碩,專利與證照的申請案逐年增加,藥廠與生技公司紛紛運用此技術生產產品,相關產業發展迅速,規模越來越大。以下以美國為例,說明 CRISPR 在技術轉移、智慧財產權及應用的現況(圖 2):
(一)專利與證照
美國麻省理工學院 Broad 實驗室的張峰(Feng Zhang)和加州大學柏克萊分校的珍妮佛 ‧ 杜德納(Jennifer Anne Doudna)是 CRISPR 專利爭奪戰兩個團隊的領導人物。自 2013 年 3 月 16 日起,美國新專利法從「先發明制(First to invent)」改採「先申請制(First inventor to file)」制,並修改專利法,以歷程調查程序(Derivation proceeding)取代專利衝突程序(Interference proceeding)。
杜德納團隊於 2013 年 3 月 15 日提出申請,而張峰團隊於 2013 年 10 月 15 日提出申請,但花費大筆經費使用優先審查服務,因此早於杜德納團隊,於 2014 年 4 月便獲得了美國專利局核准專利。目前此案仍在上訴處理中,專利歸屬仍有爭議,但預期爭議各方會有妥協的趨勢,可能會結束某些專利權而最終進行證照交換(cross license)(Cohen 2017)。
現今在美國從事 CRISPR 技術轉移的公司或機構,較著名的包括 Broad Institute、Editas Medicine、Caribou Biosciences、Intellia Therapeutics、ERS Genomics 及 CRISPR Therapeutics,其發展方向各異,但共同特徵是均為代理人(surrogate)且與專利持有者關係密切,通常只進行技術轉移,實際的生產銷售則由規模更大的藥廠或生技公司負責。對於一般性應用則通常採取非獨家的技術轉移及授權,如研究工具、農工產品、實驗動物或藥品開發等,但涉及人體治療的部分,則通常採取獨家的技術轉移及授權(Cohen 2017)。
(二)CRISPR 企業的成立
CRISPR 的發展已成功創造出新產業,造就許多 CRISPR 公司的成立(the birth of CRISPR Inc.)。
此技術首先在食品畜牧業開創出一片天地,案例如:1. 成功開發可抵抗噬菌體攻擊的乳酸生產菌株,大幅提升乳製品的產能,例如優格(yogurt)和乳酪(cheese)的生產。2. 應用於編譯動、植物或微生物基因以產出所需特性的家畜、農作物或商業化生產酵素,或是進一步製作基因轉殖動物,作為研究疾病及開發藥物的動物模式(animal model)。
生技醫療方面,鐮刀型貧血症、地中海型貧血症、裘馨氏肌肉失養症和囊腫性纖維化等,遺傳性疾病的基因治療都已在研究中或進入臨床試驗階段;更有藉此製作誘導性多功能幹細胞(induced pluripotent stem cells, iPS)和嵌合抗原接受體 T 細胞(chimeric antigen receptor T cells, CART)用於細胞、基因或免疫治療者(Cohen 2017)。其中,諾華(Novartis)的 CART 療法Kymriah(tisagenlecleucel)用於治療復發性和難治性 B 細胞急性白血病的 25 歲以下患者,是美國食品藥物管理局(US FDA)所核准上市的第一個基因療法。
![]()
(點擊圖片可放大)圖 2 :美國的 CRISPR 技術轉移相關的公司、智慧財產權持有者及應用(引用 The Birth of CRISPR Inc. Science, 17 Feb. 2017; 355(6326):683) 圖/本研究整理
在美國,CRISPR 發展與日精進;應用範圍漸廣,使專利申請十分踴躍,但獨家的技術轉移及證照授權,引發了智慧財產權持有者與各大藥廠、生技公司的商業利益競逐。自從此技術變成一門生意(business)之後,確實為美國社會帶來爭論甚至撕裂,與 CRISPR 技術相關的智慧財產權、學術榮譽、個人利益、忠誠、自我期許、地域及媒體版面等等議題,都浮上了辯論臺。當然,還有獲得諾貝爾獎的夢想(Cohen 2017)。
前景看好
CRISPR 的發展十分快速,具體可應用項目持續開展中,前景十分看好,尤其是下列三個面向,不僅業界大有可為,更可成為國家發展的推力:
(一)技術創新
CRISPR 可以加速問題的解決,如縮短基因轉殖動、植物產生的時程;更有潛力解決以往無法解決的問題,如治療病毒潛伏性感染及遺傳性疾病等。為促進生物科技的創新,與國際發展並駕齊驅,政府應制定政策鼓勵相關技術的研發。
(二)產業發展
CRISPR 應用於農工業及醫藥業,可加速產品研發的進度,增加企業的生產效率與獲利。為促進產業的升級與產學合作,政府應建立產官學界合作的管道和交流的平台,使得 CRISPR 的相關技術能從實驗室研究進入產業應用階段,加速實證醫學(translational medicine)的發展,並扶持相關產業的建立。
(三)精準治療(Precision medicine)
CRISPR 可運用於高度專一性和客製化的細胞和基因治療(cell and gene therapy),例如 iPS 細胞和 CART 細胞(圖 2,Cohen J. 2017)的製作,即在精準治療上扮演關鍵性的角色。為符合個別病人的需求,政府可擬定新政策配合,創造一個生物經濟(bioeconomics)體系和建立因應個體差異的人體生物資訊資料庫。
可能面臨的爭議與挑戰:社會、法律及倫理的層面
![]()
CRISPR 技術無疑為基因編輯帶來更多的可能性,但人類若藉此打造「理想生命」或追求「長生不老」,是否會造成問題? 圖/達文西《維特魯威人》 via wikipedia
CRISPR 已在生態、環境、風險評估及基因編譯的事務上引發了一些安全議題,我們有必要就社會、法律及倫理的層面上,作政策面的公共事務溝通,以下問題是最為大家所關切的:
(一)利益和風險的平衡(Balance of benefits and risks)
CRISPR 應用於基因編譯雖有無物種限制、簡單、準確、迅速及便宜的優點,但仍有脫靶或傳遞工具的問題,例如:脫靶可能會造成有害的突變,傳遞工具則可能具有毒性或成本很高。考量利益需評估相對之風險,以確保利益高於風險,但實務面上利益和風險評估之複雜性極高,需要利益相關者的擴大參與(Nicol etc. 2017,Rodriguez 2016)。況且各方立場及觀點往往不一,要達成平衡並不容易,須仰賴眾人建立一個科學性的利益和風險評估機制。
(二)個人利益及公共利益之兼顧(Compatibility of private interests and the public good)
張峰和珍妮佛 ‧ 杜德納在美國的專利爭奪戰引起了 CRISPR 的專利權及商業應用爭議,目前看來,大有個人利益凌駕公共利益之勢。為確保公共利益,獨家的技術轉移及授權的範圍應縮小,並增加創造發明此新技術的機構彼此間的競爭關係(Cohen 2017,Contreras and Sherkow 2017)。另一方面,技術開發者(專利持有者)與證照持有者(生產銷售者),應達成雙方協議,並制定相關專利法規,規定權利保護的時程與範圍,以增加創造發明的誘因;提高生產銷售的利潤;與保障商業利益,但應有相對義務之規定以兼顧公共利益。
(三)隨意改造基因(Random manipulation of genes)
任意編譯動物、植物及微生物基因可能會造成環境汙染和生態浩劫,最近科學家更首度成功利用CRISPR 有效的改變人類胚胎的 DNA(Sheron Begley, 2017),若任意改造人類基因體則可能會有人造人、複製人、甚至長生不老人的出現。為避免破壞環境生態和引發人類倫理危機,應用之範圍及目的須有妥善之政策規劃及法規規範,必要時應有適當的限制。
(四)人體治療商業化(Commercialization of human therapy)
CRISPR 運用在人體治療已有相當進展,近來在治療病毒潛伏性感染(如人類後天免疫不全病毒、疱疹病毒、人類乳突病毒和 B 型肝炎病毒等)、遺傳性疾病(Cohen 2017)及神經退化性疾病(如阿茲海默症、亨丁頓舞蹈症和帕金森氏症等)(Kim 2017,Li 2016)的研究上都有突破,亦相當有潛力運用在抗癌藥的研發。若這項技術可以成功運用在人類臨床治療,將有深遠的影響並帶來重大的價值。但這些疾病的療程通常耗時且費用龐大,若無管控,商業化恐在所難免。醫療人權乃普世價值,治療不應成為某些特定人的特權,政府對非歸因於己的基因治療需求者,應有適當之保險給付,並盡量降低基因治療之成本,配合合理的付費制度,以公正分配醫療資源。
臺灣的發展現況
在台灣,已有很多實驗室使用 CRISPR 作為研究工具,如製作幹細胞、基因轉殖動植物、微生物基因改造及藥品開發等,或者研究 CRISPR 引發的免疫反應,相當廣泛地用於基礎研究,並已有成果發表於學術性期刊或研討會論文、報告。在相關產業面則仍在起步階段,雖已有公司實際利用此技術從事研發和生產製造,但大多企業為代理商。
我國目前已有專利法作為專利申請的規範,有些學校或研究機關亦設有技術轉移單位,但參考國外專利申請之爭議,有關 CRISPR 的專利申請及證照持有,仍應明確規範申請流程,以鼓勵創造發明,並避免利益衝突(conflict of interest)。
近來政府及民間研究機關已投入不少經費於 CRISPR 相關的研究,例如:近 5 年科技部通過的 CRISPR 相關專題研究案及規劃推動案已有 39 件,領域涵蓋生物科學、自然科學及工程技術,核准經費總金額已超過新台幣 1 億 6 千萬元。我們團隊近來曾訪談過國內 CRISPR 相關研究人員,發現他們現階段面臨的挑戰如下表:
![]()
上表乃本團隊實地訪談後之研究整理。
CRISPR 前景看好,臺灣準備好了嗎?
CRISPR 是基因編譯的革命性發現,可快速而準確的改造標的物的基因序列,已開啟新的基因體研究世代。在國外,CRISPR 技術除已廣泛用於基礎研究外,並逐漸應用於生產農工業產品及人體治療上,不少生技公司和藥廠陸續投入研發和生產相關產品以搶食這塊商業大餅,相關產業正蓬勃發展。在台灣,CRISPR 技術主要用作為基礎研究工具,相關產業則尚在萌芽階段;儘管如此,我們預期 CRISPR 相關產業在不久的將來在台灣仍會迅速發展,並有促進產業的創新與升級之潛力。
雖然 CRISPR 在國內的發展有不少困難和挑戰待克服,相關政策亦仍在擬定中或法規仍在草案階段(如細胞與基因治療產品管理法草案),但綜觀國際科技發展趨勢,CRISPR 前景十分看好。解決技術上的困難需要發展新技術或改進原來的技術,可促進科學的進步;解決專利與證照的挑戰則有賴制定更完善的法規和政策。討論倫理問題絕非阻礙科學進步,而是一種未雨綢繆,著重解決未來可能發生的問題,對於科技發展的利弊得失及造成的衝擊進行多方面的探討,會使政策的規劃更為周延,亦有利於科技的長期良性發展。
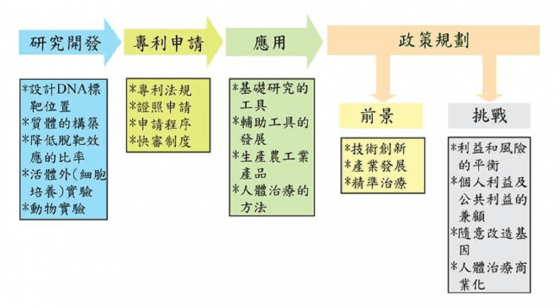
目前我們團隊正在盤點國家投入於 CRISPR 研究過程中所發現新觀念及新技術,如利用 CRISPR 作為未來研究精準治療的疾病模式等。期許我國的研究人員在從事研究的同時,不但能解決技術創新瓶頸,甚至連專利證照申請及衍生的倫理問題都能一併考量,確實因應 CRISPR 的創新發展和國際潮流趨勢,開創美好前景(圖 3)。
![]()
圖 3 :CRISPR 的研發、應用及政策規劃。 圖/本研究整理。
參考文獻:
- Basu S, Adams L, Guhathakurta S, Kim YS. (2017). A novel tool for monitoring endogenous alpha-synuclein transcription by NanoLuciferase tag insertion at the 3’end using CRISPR-Cas9 genome editing technique. Scientific report. 4 Apr. 2017; 7:45883.
- Contreras J. L. and Sherkow, J. S. (2017). CRISPR, Surrogate Licensing, and Scientific Discovery. Science, 17 Feb. 2017; 355(6326):698-700
- Cohen J. (2017).The Birth of CRISPR Inc. Science, 17 Feb. 2017; 355(6326):680-684
- DiCarlo J. E., Norville J. E., Mali P., Rios X., Aach J., Church G.M. (2013). Genome engineering in Saccharomyces cerevisiae using CRISPR-Cas systems. Nucleic Acids Research. Apr. 2013; 41(7):4336-4343.
- Horvath P. and Barrangou R. (2010). CRISPR/Cas, the immune system of bacteria and archaea. Science, 8 Jan. 2010; 327(5962):167-170.
- Mali P., Yang L., Esvelt K.M., Aach J., Guell M., DiCarlo J.E., Norville J.E., Church G.M. (2013). RNA-guided human genome engineering via Cas9. Science, 15 Feb. 2013; 339(6121):823-826.
- Nicol D, Eckstein L, Morrison M, Sherkow JS, Otlowski M, Whitton T, Bubela T, Burdon KP, Chalmers D, Chan S, Charlesworth J, Critchley C, Crossley M, de Lacey S, Dickinson JL, Hewitt AW, Kamens J, Kato K, Kleiderman E, Kodama S, Liddicoat J, Mackey DA, Newson AJ, Nielsen J, Wagner JK, McWhirter RE. (2017). Key challenges in bringing CRISPR-mediated somatic cell therapy into the clinic. Genome Medicine. 2017; 9:85.
- Rodriguez E. (2016). Ethical Issues in Genome Editing using Crispr/Cas9 System. Journal of Clinical Research & Bioethics. March 24, 2016; 7:2
- Shalem O., Sanjana N.E., Hartenian E., Shi X., Scott D.A., Mikkelsen T.S., Heckl D., Ebert B.L., Root D.E., Doench J.G., Zhang F. (2014). Genome-scale CRISPR-Cas9 knockout screening in human cells. Science, 3 Jan. 2014; 343(6166):84-87
- Sheron Begley. (2017). First Human Embryos Edited in the U.S., Scientists Say. Scientific American, 27 July 2017.
- Yang W, Tu Z, Sun Q, Li XJ. (2017). CRISPR/Cas9: Implications for Modeling and Therapy of Neurodegenerative Diseases. Frontier Molecular Neuroscience. 28 Apr. 2016; 9:30.
The post 基因研究大明星「CRISPR 基因編輯技術」的現在與未來在哪裡? appeared first on PanSci 泛科學.